Imaging of Matter
Entwicklung zukünftiger Nanomedikamente
15. Mai 2024
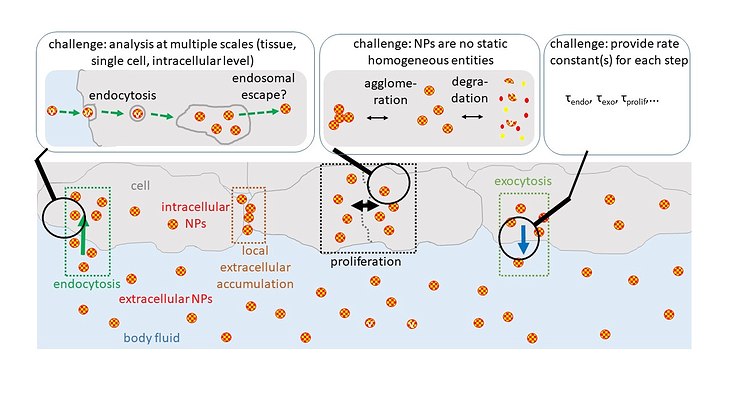
Foto: Wolfgang Parak
Die quantitative Analyse der biologischen Verteilung und Ausscheidung von Nanopartikeln kann deren Entwicklung für diagnostische und therapeutische Zwecke verbessern. In einem im Fachmagazin „Science" veröffentlichten Artikel schlagen Prof. Wolfgang Parak und Dr. Neus Feliu verschiedene bildgebende Verfahren vor, um die notwendigen quantitativen Daten zu erhalten.
Kolloidale Nanopartikel (NP) werden für die Behandlung und Diagnose von Krankheiten entwickelt, etwa als Träger von mRNA, für die photothermische Behandlung von Prostatakrebs oder als Kontrastmittel für die Magnetresonanztomographie (MRT). Der Einsatz von NP in der klinischen Praxis ist bislang jedoch begrenzt, da es nicht einfach ist, die Partikel gezielt an ihr Ziel zu bringen und zu kontrollieren, wann sie wirksam sind und wann sie aus dem Körper ausgeschieden werden.
Bessere Biodistribution würde Nebenwirkungen verringern
Grund hierfür sind die Möglichkeiten zu kontrollieren, wohin die NPs im Körper gelangen und wie sich die lokalen Eigenschaften und die Dosis im Laufe der Zeit verändern. Die Anforderungen variieren je nach Anwendung, aber im Allgemeinen würde eine verbesserte Biodistribution die Nebenwirkungen verringern. „Obwohl die meisten Mechanismen der Wechselwirkung von Nanopartikel mit Zellen und Geweben aufgeklärt sind, fehlen noch quantitative Details“, sagt Prof. Wolfgang Parak vom Fachbereich Physik der Universität Hamburg und Forscher im Exzellenzcluster „CUI: Advanced Imaging of Matter“.
Gemeinsam mit Dr. Neus Feliu vom Center für Angewandte Nanotechnologie CAN des Fraunhofer IAP in Hamburg argumentiert Parak, dass die Wechselwirkung von NPs mit Zellen mit den physikalisch-chemischen Eigenschaften der NPs wie Größe, Ladung und Form zusammenhängen. Da NPs Veränderungen unterliegen können, müssen bei der Messung von Biodistributionen stoff- und zeitabhängige Veränderungen der physikalisch-chemischen Eigenschaften der NPs berücksichtigt werden. Hinzu kommt, dass die Wechselwirkung von NPs mit Zellen nicht in einem einzigen Schritt erfolgt.
Jeder Ablauf lässt sich durch Geschwindigkeitskonstanten charakterisieren
Im Prinzip lässt sich jeder Ablauf durch eine oder mehrere Geschwindigkeitskonstanten charakterisieren, sagen die Forschenden. Wenn man diese Geschwindigkeitskonstanten kennt und weiß, wie sie von den physikalisch-chemischen Eigenschaften der NPs abhängen, könnte man das Schicksal der verschiedenen NP-Typen von ihrem Eintritt in den Körper bis zu ihrer möglichen Ausscheidung über Urin oder Stuhl vorhersagen. Folglich könnten die physikalisch-chemischen Eigenschaften der NPs so angepasst werden, dass sie der Verabreichungsmethode, dem Zielort und der Zeit bis zur Ausscheidung am besten entsprechen.
Datensätze der Geschwindigkeitskonstanten für alle beteiligten Stoffwechselwege auf Gewebe-, Zell- und intrazellulärer Ebene in Abhängigkeit von den physikalisch-chemischen Eigenschaften der NP könnten es daher ermöglichen, das Design der NP so zu gestalten, dass sie geeignete Eigenschaften für eine optimale Verabreichung und Ausscheidung aufweisen.
Parak und Feliu schlagen verschiedene Techniken wie Elektronen- und Lichtmikroskopie oder Massenspektrometrie vor, um solche Datensätze zu erhalten. Auch das Röntgenfluoreszenz-Imaging (XFI) könnte in Zukunft eine Option sein. Die größte Hürde dabei sehen die Forschenden derzeit in der Gefahr von Strahlenschäden während der Bildgebung. Außerdem leidet XFI, wie auch die optische Nahinfrarot-Bildgebung im Gewebe, unter Streueffekten. Der Hintergrund könnte jedoch durch nichtisotrope Streuung bereinigt werden, was den Weg für eine zukünftige Bildgebung tief im Gewebe ebnen würde.
Originalpublikation
Neus Feliu and Wolfgang J. Parak
„Developing future nanomedicines”
Science, 384, 6694, pp. 385-386 (2024)