Imaging of Matter
Weiterer Schritt zur Bekämpfung von Alzheimer
23. März 2023
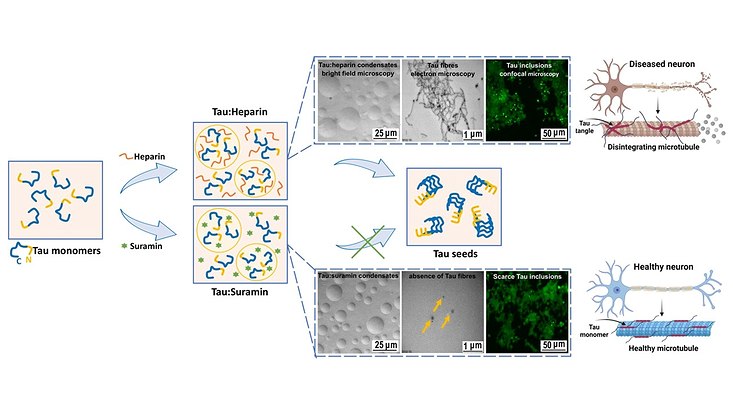
Foto: AG Betzel
Der Verlauf einer Alzheimer-Demenz lässt sich durch verschiedene Medikamente positiv beeinflussen – aufhalten oder heilen kann man die Erkrankung des Gehirns bislang nicht. Im Forschungsmagazin Scientific Reports skizziert ein Team um Prof. Christian Betzel von der Universität Hamburg einen möglichen therapeutischen Weg.
Die Alzheimer-Demenz gehört zu den sogenannten Tauopathien: Dabei lagern sich fehlerhafte Tau-Proteine an den Nervenzellen ab und schränken diese bis zur Unfähigkeit ein. Tau ist ein intrinsisch ungeordnetes neuronales Protein, das in gehäufter Form zum Hauptbestandteil der neurofibrillären Knäuel wird, die bei der Alzheimer-Krankheit beobachtet werden.
„Wir wollten herausfinden, wie genau die Aggregation des Tau-Proteins ausgelöst wird, um möglicherweise gezielt gegensteuern zu können“, sagt Christian Betzel, der auch im Exzellenzcluster „CUI: Advanced Imaging of Matter“ forscht. Im Experiment kann die Tau-Aggregation durch polyanionische Cofaktoren wie RNA oder Heparin ausgelöst werden. Dabei zeigt sich, dass dieselben Polyanionen bei unterschiedlichen Konzentrationsverhältnissen über die Flüssig-Flüssig-Phasentrennung (LLPS) Tau-Kondensate erzeugen, die mit der Zeit ein pathologisches Aggregationspotenzial entwickeln.
Die Forschenden führten zeitauflösende dynamischen Lichtstreuungsexperimenten (trDLS) und Röntgenkleinwinkelexperimente an DESYs Röntgenlichtquelle PETRA III in Kombination mit elektronenmikroskopischen Untersuchungen am Biolabor (XBI) des Europäischen Elektronenlasers EuXFEL durch, um den Prozess genauer mit hoher Orts- und Zeitauflösung zu untersuchen.
Konkurrierende Wechselwirkungen verringern das Potenzial zur Knäuelbildung
Dabei stellten sie fest, dass elektrostatische Wechselwirkungen zwischen Tau und dem negativ geladenen Arzneimittel Suramin zur Kondensation von Tau führen. Diese Wechselwirkungen konkurrieren mit den Wechselwirkungen, die die Bildung von Tau:Heparin- und Tau:RNA-Koazervaten antreiben. In der Folge verringerte sich das Potenzial, zelluläre Tau-Aggregation auszulösen. Selbst nach längerer Inkubation lösten Tau:Suramin-Kondensate keine Tau-Aggregation aus.
„Unsere Ergebnisse belegen, dass der dynamische Austausch zwischen polyanionischen Polymeren wie Heparin und RNA und anionischen Molekülen wie Suramin die Phasentrennung von Tau beeinflussen kann“, sagt Prabhu Rajaiah Prince, Post-Doktorand im Exzellenzcluster. Weitere Modifikationen werden zukünftig die Möglichkeit bieten, die Funktion von Tau in Abhängigkeit von der lokalen zellulären Umgebung abzustimmen. Diese Informationen werden bei der Suche nach Modulatoren der Tau-Kondensation helfen, so die Forschenden, die Tau-Koazervate abbauen oder ihre Umwandlung in „Tau-Seeds“ verhindern. Ziel wäre es, Therapeutika zu entwickeln, die die Tau-Aggregation im Gehirn verhindern.
Außerdem schlagen die Forschenden eine Analogie zur Theorie der Stabilität kolloidaler Suspensionen vor: Minimale Wechselwirkungen zwischen kolloidalen Tau-Partikeln könnten die Tau-Aggregation auslösen. Prince: „Wir sind der Meinung, dass die Anwendung von trDLS zur Untersuchung der Wirkung von polyanionischen Verbindungen auf die Proteinkondensation sehr gut geeignet ist, um diese Prozesse auf molekularer Ebene zu untersuchen.“
An der Arbeit waren außerdem Forschende des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) in Bonn und Berlin, der Universität Bonn und des European XFEL beteiligt.
Originalpublikation
P. R. Prince, J. Hochmair, H. Brognaro, S. Gevorgyan, M. Franck, R. Schubert, K. Lorenzen, S. Yazici, E. Mandelkow, S. Wegmann & Ch. Betzel
„Initiation and modulation of Tau protein phase separation by the drug suramin“
Scientific Reports 13, 3963 (2023)


