Imaging of Matter
Wie sich Killerkeime stoppen lassen
31. Juli 2024
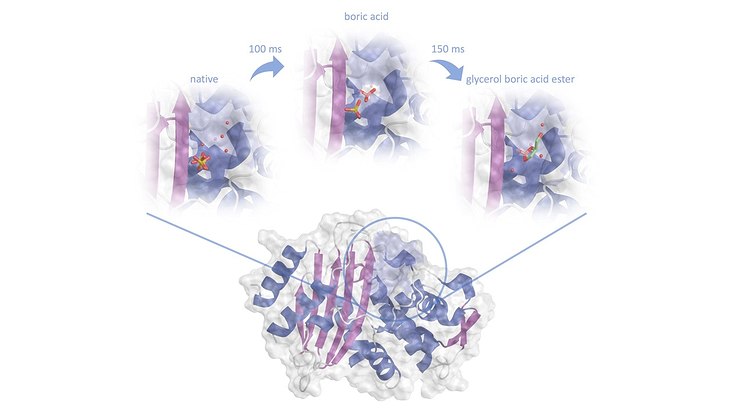
Foto: Andreas Prester, Universitätsklinikum Hamburg-Eppendorf UKE)
Forschende auf der ganzen Welt sind auf der Suche nach neuen und effizienten Wirkstoffen zur Behandlung von bakteriellen Infektionen. Ihr besonderer Fokus: Die Therapie von Erkrankungen, die durch multiresistente Bakterien verursacht werden – also Bakterien, die gegen mehrere Antibiotika widerstandsfähig sind.
Ein Forschungsteam der Universität Hamburg, des Universitätsklinikum Hamburg-Eppendorf (UKE) und von DESY hat nun an DESYs brillanter Röntgenlichtquelle PETRA III untersucht, wie sich Enzyme ausschalten lassen, die eine gängige Klasse von Antibiotika unwirksam machen. Mithilfe von PETRA III konnte das Team auch den zeitlichen Verlauf des Prozesses beobachten. Die Ergebnisse könnten helfen, ein Medikament gegen die Antibiotika-Killer zu entwickeln und die Wirksamkeit vorhandener Antibiotika zu erhalten. Ihre Studie, die auch vom Exzellenzcluster „CUI: Advanced Imaging of Matter" unterstützt wurde, veröffentlichten die Forschenden im renommierten Fachmagazin „Nature Communications Chemistry“.
Bakterien entwickelten schnell Abwehrmechanismen
Die Klassiker unter den Antibiotika sind Beta-Laktame. Zu diesen Arzneimitteln zählen auch das erste kommerziell hergestellte Antibiotikum Penicillin und seine verwandten Substanzen. Zu Beginn des 21. Jahrhunderts war die Hälfte der weltweit eingesetzten Antibiotika Beta-Laktame. Doch schon früh entwickelten Bakterien Abwehrmechanismen gegen diese Antibiotika. Ihre Werkzeuge: Beta-Laktamasen. Diese Enzyme schneiden wie molekulare Scheren den zentralen Ring des Beta-Laktam-Moleküls durch und setzen damit dessen antibiotische Eigenschaften außer Kraft.
Seit 20 Jahren suchen Forschende weltweit nach einer Möglichkeit, Beta-Laktamasen zu deaktivieren. Bisher waren die meisten der entwickelten Beta-Laktamase-Hemmer organische Verbindungen, die dem Penicillin ähneln. Sie dringen in das aktive Zentrum der Beta-Laktamasen ein und blockieren es. In einem anderen Ansatz nutzten Forschende einfachere Moleküle, um das aktive Zentrum der Enzyme zu blockieren. Allerdings entwickelten die Bakterien innerhalb weniger Jahre nach ihrer Markteinführung auch gegen diese Substanzen Resistenzen.
Andere Mittel sollen die Penicillin-Killer ausschalten
Daher versuchen Wissenschaftlerinnen und Wissenschaftler die Penicillin-Killer mit anderen Mitteln auszuschalten. Der jüngste Ansatz: Beta-Laktamase-Hemmer auf Basis von Borsäure. Medizinerinnen und Mediziner nutzen borhaltige Verbindungen bereits erfolgreich für die Behandlung einer Form von Blutkrebs. „Diese Substanzen auf Borsäurebasis funktionieren sehr gut als Beta-Laktamase-Hemmer“, sagt Andreas Prester, Erstautor der Studie und Postdoc am UKE. Prester und seine Kollegen, Markus Perbandt von der Universität Hamburg, Winfried Hinrichs, emeritierter Professor der Universität Greifswald, und Christian Betzel, Professor an der Universität Hamburg, der die Forschung leitete, haben die Hemmung durch Borsäure im Detail untersucht. Mit dem Röntgenlaser European XFEL und DESYs Synchrotronstrahlungsquelle PETRA III erforschten sie, wie die Borsäure an die Bakterienenzyme bindet. Dafür baute ein Team um Henry Chapman, leitender Wissenschaftler bei DESY, Professor an der Universität Hamburg und CUI-Sprecher, an der PETRA III-Messstation P11 ein Experiment auf, das die Bindung der Borsäure an die Aminosäure Serin im aktiven Zentrum des Enzyms in atomarer Auflösung wie einen Film zeigen konnte. Das Ergebnis: „Die Bindung zwischen Borsäure und der Enzymaminosäure ist relativ stabil. Damit verhindert die Borsäure, dass das Enzym mit dem Antibiotikum interagieren kann“, sagt Prester.
Forschende beobachten die Bindungsreaktion
Im Experiment konnten die Forschenden mit Hilfe einer Methode namens „mix and inject serial crystallography“ den zeitlichen Verlauf der Bindungsreaktion nachverfolgen. Das Forschungsteam fand heraus, dass Borsäure sehr schnell an das Enzym bindet. In einem weiteren Ansatz beobachtete das Team mit der gleichen Methode, wie das organische Molekül Glycerin an den bereits gebildeten Serin-Borsäure-Komplex bindet. „Die gewonnenen Informationen sind ein erster Schritt, um später ein Medikament zu entwickeln, das Beta-Laktamasen hemmen und die Resistenz gegen das Antibiotikum verhindern kann“, sagt Dominik Oberthür, leitender Wissenschaftler am CFEL (Center for Free Electron Laser Science), der im Forschungsteam die serielle Kristallographie leitete.
„Die Art der Verbindungen, die wir eingesetzt haben, und die entsprechenden chemischen Reaktionen, die wir zeitlich aufgelöst beobachtet haben, sind sehr weit von bisherigen Penicillin-ähnlichen Hemmstoffen entfernt“, sagt Betzel vom Institut für Biochemie und Molekularbiologie der Universität Hamburg sowie dem Excellenzcluster „CUI: Advanced Imaging of Matter". Gegen viele dieser Hemmstoffe seien Bakterien heute bereits resistent. „Im Vergleich dazu ist Borsäure ein sehr kleines Molekül. Auch wenn es dadurch nicht ganz so effizient ist wie andere Hemmstoffverbindungen, ist es gleichzeitig sehr unwahrscheinlich, dass die Bakterien in naher oder ferner Zukunft eine Resistenz gegen Borsäure entwickeln.“ Sollte sich die Borsäure vom Enzym lösen, kann ein anderes Borsäuremolekül - oder sogar dasselbe - aufgrund des wahrscheinlich reversiblen Mechanismus und seiner geringen Größe und Stabilität leicht wieder eindringen und die aktive Stelle erneut blockieren.
Die Versuche fanden bei Raumtemperatur statt: Als Nächstes wollen die Forschenden das Verhalten der Borsäure unter Umgebungsbedingungen untersuchen, die dem menschlichen Körper ähnlicher sind. Ihr Ziel: Mithilfe ihrer Ergebnisse helfen, die Mechanismen der Antibiotikaresistenz besser zu verstehen und so zur Entwicklung von Medikamenten gegen den Penicillin-Killer beizutragen, um die Wirksamkeit vorhandener Antibiotika zu erhalten. Text: DESY, red.
Originalveröffentlichung
Andreas Prester, Markus Perbandt, Marina Galchenkova, Dominik Oberthür, Nadine Werner, Alessandra Henkel, Julia Maracke, Oleksandr Yefanov, Johanna Hakanpää, Guillaume Pompidor, Jan Meyer, Henry Chapman, Martin Äpfelbacher, Winfried Hinrichs, Holger Rohde & Christian Betzel
"Time-resolved crystallography of boric acid binding to the active site serine of the β-lactamase CTX-M-14 and subsequent 1,2-diol esterification"
Nature Communications Chemistry (2024)


